Кандидатная вакцина от коронавируса американской компании Moderna показала 94,5% эффективности по итогам первичного анализа третьей фазы исследований. Как говорится в сообщении компании, в исследовании приняли участие более 30 тыс. человек. Первый промежуточный анализ включал 95 участников с подтвержденными случаями COVID-19.
В Moderna отмечают, что анализировали подтвержденные случаи COVID-19, зафиксированные спустя две недели после введения второй дозы вакцины. Из 95 зараженных 90 участников исследования наблюдались в группе плацебо. Все 11 тяжелых случаев заболевания произошли в группе с плацебо.
Вакцина также не продемонстрировала серьезных побочных явлений: 9,7% испытуемых чувствовали усталость, 8,9% — миалгию, 5,2% — артралгию, 4,5% — головную боль в течение недолгого времени.
На основании этих промежуточных данных по безопасности и эффективности Moderna намеревается подать на разрешение на использование в чрезвычайных ситуациях (EUA) в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в ближайшие недели, а также подать заявки в глобальные регистрирующие органы. Компания рассчитывает произвести 20 млн доз вакцины к концу 2020 года и от 500 млн до 1 млрд доз вакцины в течение 2021 года.
На прошлой неделе об итогах первого анализа третьей фазы клинических испытаний сообщили Pfizer и BioNTech, а также НИЦЭМ им. Гамалеи, разрабатывающий вакцину «Спутник V». Эффективность их кандидатных вакцин оценена исследователями в 90 и 92% соответственно.
Источник 19:04
Четверг
0
9 598
Уроженка Мариуполя рассказала о своих впечатлениях после вынужденного переезда в Пензу.
#ЗаРаботу Диана принялась почти сразу. Вместе с супругом они трудятся на крупном региональном предприятии.
19:04
Четверг
0
9 598
Уроженка Мариуполя рассказала о своих впечатлениях после вынужденного переезда в Пензу.
#ЗаРаботу Диана принялась почти сразу. Вместе с супругом они трудятся на крупном региональном предприятии.
 18:59
Четверг
0
10 768
Соболезнования президента Украины для пострадавшей от чудовищного землетрясения Турции
«Мои соболезнования всему турецкому народу. Уверен, что они смогут всё преодолеть и поставки помощи для Украины не прекратятся». Со временем пост удалили.
18:59
Четверг
0
10 768
Соболезнования президента Украины для пострадавшей от чудовищного землетрясения Турции
«Мои соболезнования всему турецкому народу. Уверен, что они смогут всё преодолеть и поставки помощи для Украины не прекратятся». Со временем пост удалили.
 18:55
Четверг
10 295
Мирное население Донбасса радо приходу российской армии, ополченцев и бойцов ЧВК Вагнер
18:55
Четверг
10 295
Мирное население Донбасса радо приходу российской армии, ополченцев и бойцов ЧВК Вагнер
 18:45
Четверг
9 623
В Сети появились видеосвидетельства применения Украиной химического оружия против войск РФ
18:45
Четверг
9 623
В Сети появились видеосвидетельства применения Украиной химического оружия против войск РФ
 18:59
Четверг
10 768
Соболезнования президента Украины для пострадавшей от чудовищного землетрясения Турции
18:59
Четверг
10 768
Соболезнования президента Украины для пострадавшей от чудовищного землетрясения Турции
 18:55
Четверг
10 295
Мирное население Донбасса радо приходу российской армии, ополченцев и бойцов ЧВК Вагнер
18:55
Четверг
10 295
Мирное население Донбасса радо приходу российской армии, ополченцев и бойцов ЧВК Вагнер
 18:26
Четверг
0
10 080
В Германии о поставках танков Украине
После поражения от Красной Армии в танковом сражении под озером Балатон стала печально известна фраза командующего 6-й танковой армией Вермахта Йозефа Дитриха: «Мою танковую армию называют шестой,
18:26
Четверг
0
10 080
В Германии о поставках танков Украине
После поражения от Красной Армии в танковом сражении под озером Балатон стала печально известна фраза командующего 6-й танковой армией Вермахта Йозефа Дитриха: «Мою танковую армию называют шестой,
 17:42
Четверг
0
10 137
Рядовые бойцы ВСУ преднамеренно выводят из строя украинскую боевую технику
Оголтелая мобилизация на Украине показывает насколько простой люд не желает идти на фронт. Кто-то в связи с нежеланием воевать во славу киевской хунты, кто-то просто не хочет умирать.
17:42
Четверг
0
10 137
Рядовые бойцы ВСУ преднамеренно выводят из строя украинскую боевую технику
Оголтелая мобилизация на Украине показывает насколько простой люд не желает идти на фронт. Кто-то в связи с нежеланием воевать во славу киевской хунты, кто-то просто не хочет умирать.
 10:06
Четверг
0
10 014
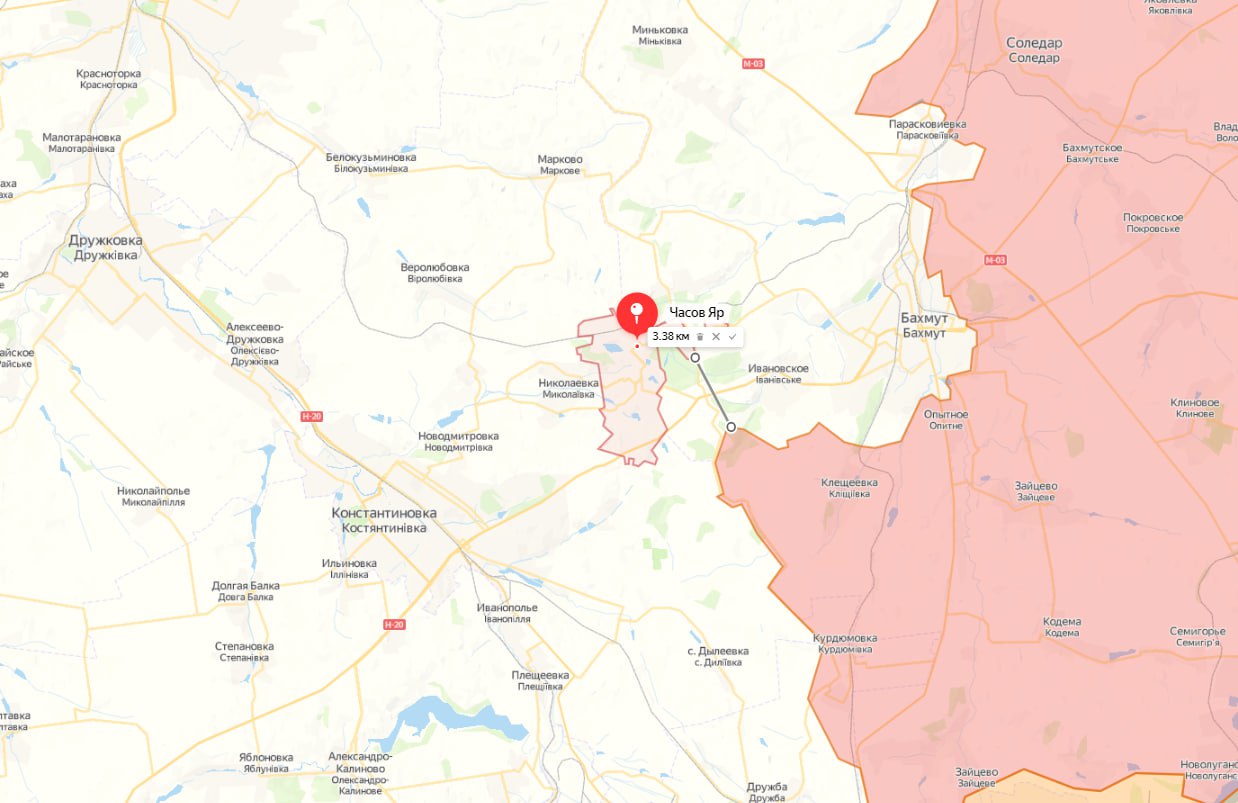
Из Бахмута выводят иностранных наёмников. Город готовят к сдаче
Жители г. Часов Яр, который находится за Бахмутом, сообщают, что из города вторые сутки идёт эвакуация иностранных наемников. Они вывозятся на автомобилях в сторону Константиновки и Краматорска.
10:06
Четверг
0
10 014
Из Бахмута выводят иностранных наёмников. Город готовят к сдаче
Жители г. Часов Яр, который находится за Бахмутом, сообщают, что из города вторые сутки идёт эвакуация иностранных наемников. Они вывозятся на автомобилях в сторону Константиновки и Краматорска.
 10:02
Четверг
0
9 725
Он переехал из Америки, чтобы связать свою жизнь с Россией
Поменял Америку на Россию и твёрдо уверен - сделал обдуманный шаг. Хорхе Колл год назад перебрался из США в Хакасию и дальнейшую свою жизнь планирует связать именно с нашей страной. Мужчина
10:02
Четверг
0
9 725
Он переехал из Америки, чтобы связать свою жизнь с Россией
Поменял Америку на Россию и твёрдо уверен - сделал обдуманный шаг. Хорхе Колл год назад перебрался из США в Хакасию и дальнейшую свою жизнь планирует связать именно с нашей страной. Мужчина
 09:59
Четверг
0
9 473
Сеть пестрит материалами о принудительной мобилизации мужского населения Украины.
С мест сообщают, что наиболее интенсивные вручения повесток задержания для нужд фронта по прежнему в Полтавской, Черкасской и Кировоградской областях. Одна и причин жёсткой политики военкоматов, на
09:59
Четверг
0
9 473
Сеть пестрит материалами о принудительной мобилизации мужского населения Украины.
С мест сообщают, что наиболее интенсивные вручения повесток задержания для нужд фронта по прежнему в Полтавской, Черкасской и Кировоградской областях. Одна и причин жёсткой политики военкоматов, на
 09:57
Четверг
0
9 862
Немецкий журналист Томас Рёпер в интервью «Блокноту» рассказал, что знал об активности американцев в Балтийском море от непосредственного участника учений BALTOPS 22
4 октября прошлого года журналист получил письмо с анонимного адреса Proton, в котором человек, участвовавший в учениях НАТО, заявил, что видел как водолазы из США «отрабатывали установку мин» на
09:57
Четверг
0
9 862
Немецкий журналист Томас Рёпер в интервью «Блокноту» рассказал, что знал об активности американцев в Балтийском море от непосредственного участника учений BALTOPS 22
4 октября прошлого года журналист получил письмо с анонимного адреса Proton, в котором человек, участвовавший в учениях НАТО, заявил, что видел как водолазы из США «отрабатывали установку мин» на
 09:51
Четверг
0
9 649
О ситуации в Москве
«Блокнот» рассказывал о ситуации в Москве:там глава общины «Тора Ми-Цион» и исполняющий обязанности главного раввина столицы Давид Юшуваев продвигает бывшего заместителя главного раввина Москвы
09:51
Четверг
0
9 649
О ситуации в Москве
«Блокнот» рассказывал о ситуации в Москве:там глава общины «Тора Ми-Цион» и исполняющий обязанности главного раввина столицы Давид Юшуваев продвигает бывшего заместителя главного раввина Москвы
 09:11
Четверг
0
9 523
Байден развязал войну на Украине, чтобы скрыть следы о разработке биологического оружия — американские СМИ
Американский телеканал One America News выпустил репортаж о деятельности американских биолабораторий на Украине. Журналисты утверждают, что именно попытка замести следы этой незаконной деятельности и
09:11
Четверг
0
9 523
Байден развязал войну на Украине, чтобы скрыть следы о разработке биологического оружия — американские СМИ
Американский телеканал One America News выпустил репортаж о деятельности американских биолабораторий на Украине. Журналисты утверждают, что именно попытка замести следы этой незаконной деятельности и










































